T 細胞疲労の理解: 免疫機能と治療介入への影響
T 細胞は適応免疫の中心人物であり、感染した細胞や異常な細胞を認識して排除する役割を担っています。抗原に遭遇すると、T 細胞はクローン増殖とエフェクター細胞またはメモリー細胞への分化を起こし、脅威を排除するためにさまざまな機能を実行します。ただし、慢性感染症やがんなど、持続的に抗原にさらされるシナリオでは、T 細胞が機能的に疲弊し、免疫反応の低下につながる可能性があります。 T 細胞疲労または枯渇として知られるこの現象は、免疫機能や治療介入への影響から大きな注目を集めています。
T細胞疲労のメカニズム:
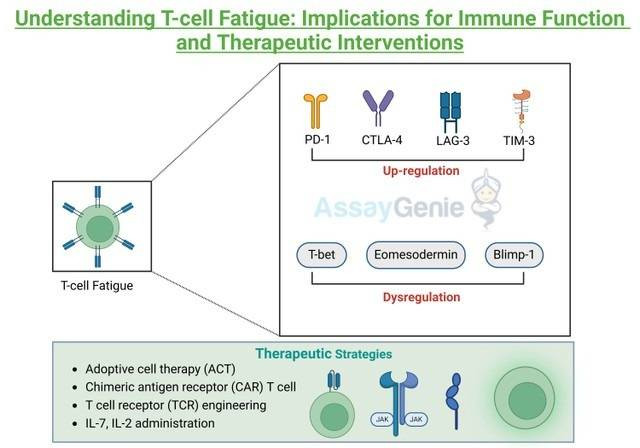
T 細胞疲労は、抑制性受容体の持続的な発現を伴う、エフェクター機能と増殖能力の進行性の喪失を特徴とします。 T 細胞疲労の根底にある分子機構には、さまざまなシグナル伝達経路と転写調節因子の間の複雑な相互作用が関与しています。慢性的な抗原刺激は、プログラム細胞死タンパク質 1 (PD-1)、細胞傷害性 T リンパ球関連タンパク質 4 (CTLA-4)、リンパ球活性化遺伝子 3 (LAG-3)、T 細胞免疫グロブリンおよびムチンドメイン含有-3 (TIM-3) などの抑制性受容体のアップレギュレーションを引き起こします。これらの受容体は、標的細胞または抗原提示細胞上で過剰発現されることが多いそのリガンドと結合すると、抑制性シグナル伝達カスケードを開始し、T 細胞の活性化とエフェクター機能を弱めます。さらに、枯渇した T 細胞の転写プロファイリングにより、エフェクターと枯渇プログラムを調整する T-bet、エオメソデルミン (Eomes)、Blimp-1 などの主要な転写因子の発現調節異常が明らかになります。さらに、ミトコンドリア機能の障害と解糖を特徴とする代謝の再プログラミングは、疲労時の T 細胞の機能不全に寄与します。

T細胞疲労の結果:
T細胞疲労の治療戦略:
T 細胞疲労の根底にある分子機構を理解することで、疲弊した T 細胞を若返らせ、免疫機能を回復することを目的とした治療戦略の開発への道が開かれました。 PD-1、CTLA-4、LAG-3 などの阻害性受容体を標的とする免疫チェックポイント遮断 (ICB) 療法は、T 細胞媒介の抗腫瘍応答を解き放つことでがん治療に革命をもたらしました。同様に、ミトコンドリア機能の強化や解糖の調節など、代謝経路を標的とした介入は、T 細胞の枯渇を逆転させる可能性を秘めています。さらに、キメラ抗原受容体 (CAR) T 細胞や T 細胞受容体 (TCR) エンジニアリングなどの養子細胞療法 (ACT) アプローチは、がんや慢性感染症に対する T 細胞応答を増強するための個別化された戦略を提供します。さらに、インターロイキン-2 (IL-2) やインターロイキン-7 (IL-7) の投与などのサイトカインベースの治療は、T 細胞の増殖とエフェクター機能を強化し、疲労に関連する欠陥を克服できる可能性があります。
結論:
T 細胞疲労は、機能的疲労と持続的な抑制性シグナル伝達を特徴とする複雑な免疫学的状態を表します。 T 細胞の枯渇を引き起こす分子機構の解明により、免疫調節と治療の機会について貴重な洞察が得られました。免疫チェックポイント阻害療法は、疲弊した T 細胞を活性化し、持続的な抗腫瘍反応を引き出すことに目覚ましい成功を収めていることが実証されています。ただし、さらなる治療標的を明らかにし、さまざまな疾患環境における T 細胞疲労と戦うための既存の戦略を改良するために、さらなる研究が保証されています。最終的には、T 細胞免疫の可能性を最大限に活用することが、感染症やがんに対する効果的な免疫療法を開発する鍵となります。
参考文献:
Wherry, E.J.、Kurachi, M. (2015)。 T 細胞の枯渇に関する分子および細胞の洞察。 Nature Reviews Immunology、15(8)、486–499。
ポーケン、K.E.、ウェリー、E.J. (2015)。スナップショット: T 細胞の枯渇。セル、163(4)、1038–1038.e1。
C. U. ブランク、W. N. ハイニン (2019)。癌および慢性ウイルス感染症における T 細胞機能不全の対照: 癌免疫療法への影響。免疫学的レビュー、276(1)、1–7。
マクレーン、L.M.、アブデルハキーム、MS (2019)枯渇した CD8 T 細胞の生物学を理解する: エイズ、癌、慢性感染症についての教訓。感染症ジャーナル、220(3)、174–185。
カーン、O.、ジャイルズ、J.R.、マクドナルド、S.、マン、S.、Ngiow、SF、パテル、K.P.、ヴェルナー、M.T.、フアン、A.C.、アレクサンダー、K.A.、ウー、J.E.、アタナシオ、J.、ヤン、P.、ジョージ、S.M.、ベンシュ、B.、スタウプ、R.P.、ドナヒュー、 G.、Xu、W.、Amaravadi、R.K.、Xu、X.、…Wherry、E.J. (2019)。 TOX は、CD8+ T 細胞の枯渇を転写的およびエピジェネティックにプログラムします。自然、571(7764)、211–218。
Paley, M.A.、Kroy, D.C.、Odrizzi, P.M.、Johnnidis, J.B.、Dolfi, D.V.、Barnett, B.E.、Bikoff, E.K.、Robertson, E.J.、Lauer, G.M.、Reiner, S.L.、およびWherry, E.J. (2012)。 CD8+ T 細胞の前駆細胞と末端サブセットは協力して慢性ウイルス感染を抑制します。科学、338(6111)、1220–1225。
Im、S.J.、橋本、M.、ガーナー、M.Y.、リー、J.、キシック、H.T.、バーガー、M.C.、シャン、Q.、ヘイル、J.S.、リー、J.、ナスティ、T.H.、シャープ、A.H.、フリーマン、G.J.、ジャーメイン、R.N.、中谷、H.I.、シュエ、H.-H.、およびアーメド、 R. (2016)。 PD-1 療法後に急激な増殖をもたらす CD8+ T 細胞の定義。自然、537(7620)、417–421。
31st Dec 2024
Recent Posts
-
Understanding Myeloid Cell Networks in Cancer Immunotherapy
癌免疫療法における骨髄細胞ネットワークの理解免疫療法は癌治療に革命をもたらしましたが、治療後に元の免疫応答を再確立する効果は限られています。本記事では、骨髄細胞ネットワークがこのプロセスにおいて重要な …21st Aug 2025 -
PD-L1 in Cancer Immunotherapy: Insights from Recent Research
癌免疫療法におけるPD-L1:最近の研究からの洞察最近の癌免疫療法の進展は、腫瘍による免疫回避を媒介する プログラム死リガンド1 (PD-L1) の重要な役割を強調しています。本記事では、PD-L1 …21st Aug 2025 -
Role of CD25+FOXP3+CD45RA- Treg Cells in Cancer Prognosis
CD25+FOXP3+CD45RA- Treg細胞の癌予後における役割はじめに制御性T細胞(Treg細胞)は、免疫の恒常性と耐性を維持する上で重要な役割を果たすT細胞の特化したサブセットです。これらの …1st Aug 2025